>Page Description
Bem vindo ao conteúdo de Química, Selecione algum dos conteúdos disponibilizados na lista abaixo e confira a resolução das atividades propostas na seção 'Sand Box'.
>Content Index
>SandBox
$ Conceito dos Gases
Os gases são moléculas ou átomos que se movimentam constantemente. Dentre as suas características, podemos destacar volume variável, difusibilidade e compressibilidade.
O estado gasoso é um dos três estados físicos da matéria, por isso é muito importante entender a constituição, propriedades e características dos gases porque eles estão muito presentes em nosso cotidiano, sendo, inclusive, indispensáveis para os vegetais e animais, bem como para o desenvolvimento da sociedade, pois influenciam campos como o da indústria e o dos meios de transportes.
~ Exemplos de gases moleculares

Agora falando de gases formados por átomos, isso ocorre somente no caso dos gases nobres (pertencentes à família 18 da tabela periódica). Entre eles, temos o gás hélio (He), que é usado para encher balões e no tratamento de asma junto ao oxigênio, pois assim se reduz o esforço muscular da respiração; e o gás neônio (Ne), que é muito usado em letreiros luminosos, pois, quando se passa uma descarga elétrica nesse gás em um tubo a baixa pressão, ele emite uma coloração laranja-avermelhada (daí a origem do termo “neon”). Vale destacar que os que são de outras cores não contêm o neônio, mas sim outros gases.

Visto que não podemos ver as moléculas e os átomos que formam os gases, os cientistas criaram um modelo conhecido como teoria cinética dos gases ou teoria do gás ideal, que é usado para explicar o comportamento deles.
Segundo essa teoria, os gases são formados por partículas que ficam bem afastadas umas das outras e que estão em movimento constante, de forma veloz, livre e desordenada. O aumento da temperatura faz com que essas partículas movimentem-se com maior velocidade, pois há aumento de sua energia cinética média, que é diretamente proporcional à temperatura termodinâmica (na escala kelvin), conforme mostra a equação a seguir:
EC = k . T
Além disso, a teoria cinética dos gases considera que os gases ideais possuem as seguintes características principais:
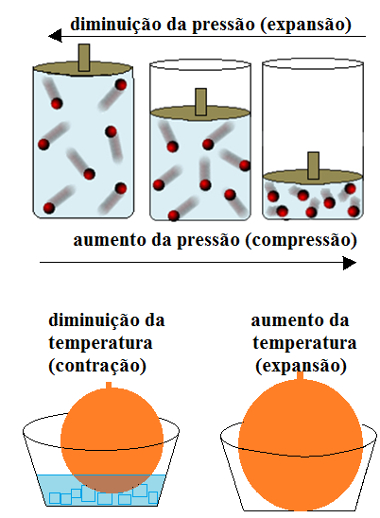
O volume dos gases é variável, adaptando-se ao volume do recipiente.
~ Volume dos gases
↓ Densidade = massa / volume ↑
$ Difusão e Efusão dos Gases
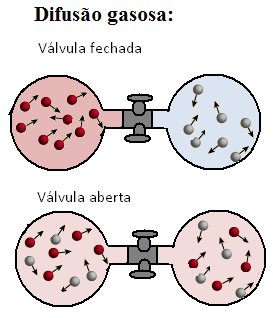
A difusão de um gás é o seu espalhamento em outro meio gasoso, e a efusão é um vazamento dos gases através de pequenos orifícios.
Vários fenômenos do cotidiano, relacionados aos gases, têm relação com duas propriedades muito importantes, que são a difusão e a efusão.
A difusão é a capacidade que as moléculas dos gases (ou átomos, no caso dos gases nobres) têm de se movimentarem espontaneamente através de outro gás.
O ar que respiramos é uma mistura de gases, sendo que os principais são o gás nitrogênio e o gás oxigênio. Veja alguns exemplos de difusão de gases através do ar que ocorrem em nosso cotidiano:

Em todos esses casos, temos um gás difundindo-se por outros gases (do ar). O resultado é uma mistura de gases, que sempre será homogênea.
Já a efusão é uma espécie de difusão, pois se refere ao movimento espontâneo das partículas de um gás através de um ou vários orifícios, indo na direção de um ambiente com pressão menor.
Por exemplo, notamos que um balão com o tempo murcha. Isso ocorre porque o gás dentro do balão acaba passando pelos pequenos orifícios da borracha.

Visto que a movimentação de um gás está relacionada à energia cinética das partículas e que quanto maior a temperatura, maior é a energia cinética. Então concluímos que quanto maior for a temperatura do gás, maior será a velocidade de difusão e efusão.
Mas e quando a pressão e a temperatura dos gases são iguais? Como sabemos qual é a sua velocidade de difusão? A resposta foi dada pelo químico escocês Thomas Graham (1805-1869). Leia o texto Lei de Graham para entender melhor sobre esses aspectos quantitativos.

$ Pressão
Visto que as moléculas dos gases estão em contínua movimentação desordenada, elas se chocam com as paredes do recipiente que as contém, assim a intensidade dessa força por unidade de área das paredes dá o valor da pressão exercida pelo gás.
A Terra está envolvida por uma camada de ar com espessura de aproximadamente 800 km; e, em razão da gravidade, as camadas superiores comprimem as que estão embaixo. Assim, a pressão exercida pelos gases presentes na atmosfera sobre uma unidade de área de determinada superfície nos fornece a pressão atmosférica.
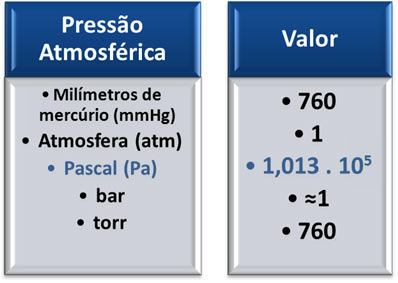
O primeiro cientista a medir o valor da pressão atmosférica ao nível do mar foi Evangelista Torricelli (1608-1647). Ele inverteu um tubo preenchido de mercúrio (Hg) sobre um recipiente contendo o mesmo líquido e observou que o mercúrio não escoava completamente: ficava um espaço vazio depois que o mercúrio escoava até a altura de 760mm.
Desse modo, a pressão ao nível do mar passou a ser equivalente a 760 mmHg. Abaixo temos as conversões para outras unidades usadas para pressão. No entanto, lembre-se de que a unidade do SI (Sistema Internacional de Unidades) é o Pascal (Pa), que é a mesma coisa que a força de 1 N aplicada em 1 m2 de área. Em outras palavras, 1 Pa é igual a 1N/m2.
No entanto, esses valores são apenas ao nível do mar. Se variarmos o lugar em que se realiza o experimento de medição da pressão atmosférica, veremos que a pressão varia com a altitude de modo inversamente proporcional, ou seja:
Quando maior a altitude, menor será a pressão atmosférica e vice-versa.
Isso ocorre porque em regiões de grande altitude há uma menor quantidade de partículas do ar por unidade de volume, por isso a pressão será menor. Quanto maior for o número de partículas, mais colisões acontecerão e a pressão exercida será maior.

A pressão P do gás depende da quantidade de colisões que as partículas dele realizam contra as paredes do recipiente que o confina. Quanto maior for o número de colisões, maior será a pressão exercida pelo gás, além disso, a pressão é diretamente proporcional à temperatura T.
~ Transformação isobárica - pressão constante
Os gases ideais podem sofrer transformações de estado termodinâmico e manter sua pressão constante.
~ Vi/Ti = Vf/Tf
$ Volume
O volume é uma das três variáveis de estado dos gases (as outras são a pressão e a temperatura). Todos os gases têm massa, porém eles não possuem forma definida nem volume constante.
O volume de um gás corresponde ao espaço que ele ocupa e isso depende do recipiente no qual ele está contido, pois por maior que seja o recipiente, o gás ocupará totalmente o volume que lhe for oferecido.
Isso se deve ao fato de que os gases são formados por partículas (átomos ou moléculas) que se movimentam velozmente de maneira contínua e desordenada em todas as direções e sentidos. As partículas dos gases continuam o seu movimento linear que só é redirecionado quando elas se chocam umas com as outras ou com as paredes do recipiente.
Devido a esse movimento contínuo, as partículas dos gases não se depositam no solo pela ação da gravidade e, consequentemente, o volume do gás irá coincidir com o próprio volume do recipiente que o contém.
O volume dos gases está diretamente relacionado com a temperatura, pois quando aumentamos a temperatura do sistema, as partículas do gás movimentam-se ainda mais rápido, expandindo-se. Mas, se diminuirmos a temperatura, ocorrerá a contração do gás.
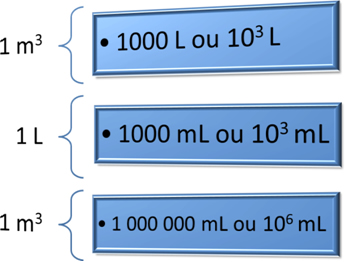
No SI (Sistema Internacional de Unidades), a unidade usada para expressar o volume dos gases é o m3 (metro cúbico). Mas, em Química, também se utiliza muito o litro (L) e o mililitro (mL), quando se trabalha em pequena escala.
Para converter essas unidades, você poderá usar as seguintes relações abaixo:

O volume V do gás é medido pelo espaço médio que esse gás ocupa. Nas condições normais de temperatura e pressão (25 ºC e 1 atm), um mol de gás ideal ocupa o volume de 22,4 l.
~ Transformação isovolumétrica - volume constante
Quando um gás ideal sofre uma transformação a volume constante, dizemos que houve uma transformação isovolumétrica, isométrica ou isocórica. Esse tipo de transformação ocorre em gases confinados em recipientes rígidos, que não são capazes de expandir-se ou contrair-se.
As transformações isovolumétricas são descritas pela segunda lei de Charles e Gay-Lussac:
~ Pi/Ti = Pf/Tf
$ Temperatura
A temperatura de um corpo é a expressão macroscópica da movimentação de seus átomos e moléculas. Quanto maior for a agitação dos átomos ou, em outras palavras, quanto maior for a velocidade média dos átomos, maior será a temperatura do corpo. É importante relembrar que, no estudo dos gases, a temperatura dos gases deve ser medida em kelvin.
~ Transformação isotérmica - temperatura constante
Quando um gás ideal passa por uma transformação em que a sua temperatura permanece constante, dizemos que ele passou por uma transformação isotérmica. A transformação isotérmica é definida pela lei de Boyle-Mariotte:
~ Pi.Vi = Pf.Vf
$ MOL
O número de mols mede a quantidade de partículas contidas em certa porção de matéria. De acordo com a lei de Avogadro, um mol de determinado elemento contém cerca de 6,02.1023 átomos. A quantidade de mols pode ser determinada com base na massa do gás e na massa molar da substância que compõe o gás, observe:
~ n = m/M
$ Variáveis de estado dos gases
As equações que iremos apresentar a seguir relacionam as três transformações gasosas de uma massa fixa de gás.
~ PV = K V/T = K P/T = K
P, V e T são as chamadas “Variáveis de estado dos gases”.
Onde PV = K se refere à transformação Isotérmica, neste caso a constante é a temperatura.
V/T= K: é a equação para transformações Isobáricas, onde a pressão é constante.
A transformação Isovolumétrica é representada pela equação: P/T = K
As transformações gasosas podem ser representadas por uma única equação. A chamada Equação geral dos gases:
.jpg)
Através dessa equação podemos descobrir, por exemplo, as alterações do volume de um gás em determinadas condições de temperatura e pressão.
$ Gás Perfeito
Um gás perfeito se encontra em recipiente fechado, suas moléculas se agitam, essa ação é conhecida como Energia cinética (Ecin) das moléculas. Se aumentarmos a temperatura dentro do recipiente teremos um aumento da Ecin . Um gás perfeito é aquele que tem sua temperatura e Ecin aumentando proporcionalmente, ou seja, de forma equilibrada.
Equação de estado dos Gases perfeitos:
PV = nRT
$ Equação de Clapeyron
Equação de Clapeyron, também conhecida como a lei geral dos gases ideais, é usada para descrever o estado termodinâmico dos gases ideais por meio das grandezas de pressão, volume e temperatura. A equação de Clapeyron foi enunciada por Émile Clapeyron, em 1834, e funciona como uma generalização das leis empíricas de Boyle, Charles, Gay-Lussac, e Avogadro.
~ Definição da equação de Clapeyron
A equação de Clapeyron é derivada das leis dos gases ideais e também da teoria cinética dos gases. De acordo com a equação de Clapeyron, pressão, volume, temperatura e número de mols relacionam-se de acordo com a seguinte expressão: